
미국 제약회사 모더나가 자사 백신의 최종 임상시험 결과 94.1%의 효과를 나타냈다고 발표했습니다. 미국 정부는 이번 달 크리스마스 이전에라도 백신 접종이 시작될 수 있다고 밝혔습니다.
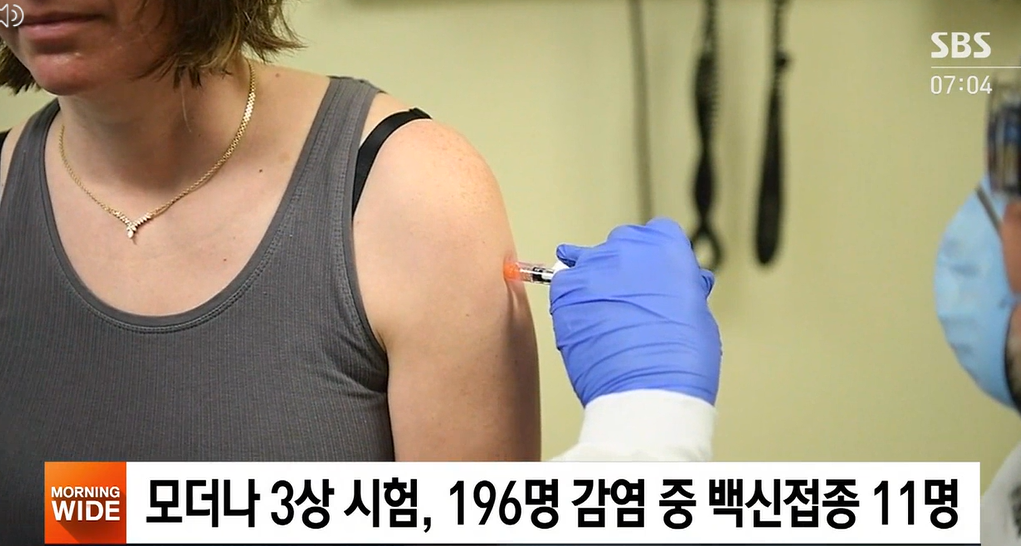

모더나 백신의 3상 임상시험에는 3만여 명이 참여했습니다. 이 가운데 196명이 코로나19에 감염됐는데, 확진자 가운데 모더나 백신을 접종한 사람은 11명이었습니다. 모더나 측은 백신의 효과가 94.1%에 이른다고 밝혔습니다.

특히 백신 접종자 가운데 중증 환자는 한 명도 없었습니다. 모더나 측은 즉시 미국 식품의약국 FDA와 유럽의약품청 EMA에 긴급 사용 승인을 신청했습니다.

FDA는 우선 오는 10일 자문위원회 회의를 열고, 앞서 지난달 20일 긴급 사용 승인을 신청했던 화이자의 백신을 먼저 심의할 예정입니다. 모더나 측은 FDA가 그 일주일 뒤인 오는 18일 자사의 백신을 심의할 것이라고 밝혔습니다.


스티브 방셀/모더나 최고경영자 : 2천만 회분을 올해 말까지 생산할 겁니다. 긴급사용 승인이 나면 곧바로 전국으로 유통할 것이고, 승인으로부터 24시간 내에 공급하려고 합니다.

앨릭스 에이자 미 보건복지부 장관은 "화이자와 모더나, 두 개의 백신이 올해 크리스마스 전 미국인에게 투여될 수 있다"고 밝혔습니다. 우리 정부는 국제 백신 협력체인 코백스를 통해 화이자와 모더나, 두 백신을 확보할 계획으로 알려졌습니다.
모더나 백신 긴급사용 승인 신청…팬데믹 판도 바뀌나
미국 제약회사 모더나가 미국과 유럽에 코로나19 백신을 긴급사용 승인 신청했다. 미국 식품의약국(FDA)에 긴급사용 승인을 신청한 것은 화이자-바이오엔테크에 이은 두 번째다. 이달 심의를 통과하면 연내 공급이 가능할 전망이다. 장기간 코로나19 로 사회·경제적 피로감이 높은 상황에서 백신이 ‘게임 체인저’가 될 수 있을지 기대감이 높아지고 있다.

■아스트라제네카 추가 실험
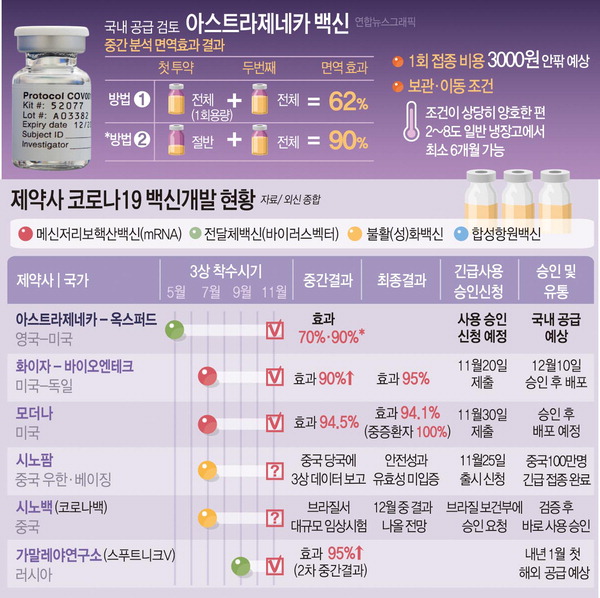
모더나·화이자와 함께 백신 개발에 앞서가던 영국 제약회사 아스트라제네카와 옥스퍼드대의 백신은 최근 접종 용량에 따라 효과가 차이를 보이고, 연령별 효과에 대해서도 의문이 제기되면서 추가 임상에 들어간다. 이 백신은 국내 업체인 SK바이오사이언스가 백신 위탁생산을 맡아 우리나라가 물량을 확보할 수 있을 것으로 기대됐지만, 개발 지연에 따라 일정이 불투명해졌다.
아스트라제네카 측은 지난달 23일 백신 3상 임상시험 초기 데이터를 분석한 결과 평균 70%의 면역 효과를 확인했다고 발표했다. 그러나 백신의 1회분 정량을 한 달 간격으로 2회 온전히 투여한 경우 면역 효과가 62%였지만, 1차 접종 때 정량의 절반만 투여하고 2차 접종 때 정량을 투여한 효과가 90%까지 증가했고, 이는 연구진의 실수라는 사실이 알려지면서 오류가 지적됐다.
아스트라제네카 측은 추가 임상을 하더라도 영국과 유럽연합(EU)에서 백신 승인이 지연될 가능성은 낮을 것으로 전망했다. 하지만 미국은 FDA가 외국에서 임상 시험을 진행한 백신에 대해 승인 절차가 까다로워 더 많은 시간이 소요될 것으로 보인다.
국내백신은?
■국내 백신 개발 1년 더 걸릴 듯
한국 기업도 백신 개발에 한창이다. 다만 국내 백신은 화이자나 모더나 등 다국적 제약사에 비해 아직 초기 개발 단계여서 빠른 상용화를 기대하기는 어렵다. 바이오업계에서는 빨라도 내년 하반기가 되어야 국산 백신이 나올 것으로 보고 있다. 현재 국내 개발 백신 중 임상 승인된 것은 제넥신과 SK바이오사이언스 2건이다.
제넥신은 DNA 백신 후보물질 ‘GX-19’의 임상 1상을 진행 중이며, 이달이나 내년 1월 논문을 통해 임상 결과를 발표할 예정이다. SK바이오사이언스는 지난 24일 백신 후보물질 ‘NBP2001’에 대한 임상 1상 시험계획을 식약처로부터 승인 받고 임상에 돌입했다. 진원생명과학은 동물실험을 진행 중이며, 이달 식약처에 임상 1상 승인을 신청했다.
모더나 백신 긴급사용 신청에 주가 20% 이상 폭등

미국의 다국적 제약사 모더나가 미국 식품의약국(FDA) 등 관련 기관에 코로나19 백신의 긴급사용 승인 신청을 한다는 소식에 지난달 30일(현지시간) 모더나의 주가는 20% 넘게 폭등했다.
이날 모더나의 주가는 뉴욕증권거래소에서 전거래일보다 25.71달러(20.24%) 폭등한 152.74달러를 기록했다. 이어 시간외거래에서도 2% 이상 상승세를 이어가고 있다.
이로써 올 들어 모더나의 주가는 7배 이상 급등했으며, 시가총액도 600억 달러를 돌파했다.
모더나는 이날 미국과 유럽에 코로나19 백신의 사용승인 신청을 한다고 밝혔다. 모더나는 코로나19 백신 후보물질의 3상 임상시험 결과, 94.1%의 예방효과를 이끌어냈다며 이같이 설명했다.
유럽 EMA, "화이자 백신허가 29일 결정, 모더나는 1월12일"

유럽연합(EU)의 의료 규제 당국인 유럽의료국(EMA)은 1일 미국 화이자와 독일 비오엔테크 공동 개발의 코로나 19 백신에 대한 사용인가 결정을 전문가 회의로 12월29일 내릴 방침이라고 발표했다.
또다른 미국 제약사 모더나의 백신 개발품에 대한 결정은 내년 1월12일 회의를 통해 내릴 것이라고 덧붙였다.
앞서 11월9일 가장 먼저 3상 실험 결과를 발표했던 화이자와 비오엔테크는 18일 4만4000명 접종을 통한 백신의 예방성공률을 90%에서 95%로 상향 발표한 뒤 20일 미국 식품의약국(FDA)와 영국 의료건강관리규정국(MHRA)에 데이터와 함께 긴급사용 허가 신청서를 냈다.
화이자는 이어 30일 27개 회원국의 유럽연합 산하 EMA에 사용허가를 신청했다고 1일 발표했다. 이에 EMA가 화이자 백신에 관한 결정을 12월29일 내린다고 밝힌 것이다.
화이자 백신
허가가 떨어지면 다음날부터 화이자와 비오엔테크는 이미 제조해놓은 백신 주사약을 공급하게 된다.
EMA에 앞서 미국의 FDA가 화이자 백신에 대한 사용허가 결정 회의를 12월10일 열 예정으로 있어 잘하면 그 다음날부터 화이자와 비오엔테크 백신이 미국 여러 곳에 배급될 수 있다. 화이자는 12월에 사용하기 위해 5000만 주사분 백신을 만들고 있다고 말했었다.
모더나 백신
FDA는 화이자에 이어 12월17일 모더나 백신에 대한 사용허가 결정을 내릴 예정이다. 허가가 나면 늦어도 21일부터 모더나와 미 국립보건원(NIH)가 개발한 코로나 19 백신도 미국에 뿌려진다. 모더나는 12월에 2000만 주사분을 마련하고 있으며 2021년에는 전세계에 10억 주사분을 제공하겠다고 말했다.
앞서 모더나는 화이자보다 일주일 늦은 11월16일 3만 명을 대상으로 한 3상 실험 결과 예방성공률이 94.5%에 달했다고 발표했다. 이어 30일 성공률을 94.1%로 변경하고 중증 예방률 100%를 재확인한 최종 결과와 함께 미 FDA 및 EU EMA에 각각 사용허가를 신청했다고 알렸다.




댓글